2. 1 Structure
Le lactose est un disaccharide constitué de D-galactose et de D-Glucose reliés entre eux par une liaison osidique β(1-4). De ce fait, il possède une fonction réductrice portée par l’unité glucose.
Structure chimique du lactose (D-galactopyranosyl (1-4) D-glucopyranose)
Crédits
Fondements physicochimiques de la technologie laitière, T. Croguennec, R Jeantet, G Brulé, Ed TEC & DOC, Lavoisier, Paris, 2008
La structure hémiacetal du résidu glucose conduit à un équilibre en solution entre deux anomères, a et b, qui diffèrent par la configuration du carbone anomérique (C1 du résidu glucose). L’équilibre thermodynamique entre les deux anomères implique l’ouverture de l’hémiacétal ; bien qu’en faible proportion, la molécule de lactose en configuration ouverte est la forme réactive de la molécule de lactose. Elle confère au lactose des propriétés semblables aux aldéhydes (possibilité d’oxydation et de réduction, réactivité dans la réaction de Maillard).
2. 2 Pouvoir sucrant
Le pouvoir sucrant du lactose est faible : en solution modèle il n’est que le tiers d’une solution de saccharose et le quart d’une solution de fructose.
| Carbohydrate | Pouvoir sucrant relatif |
| Saccharose | 1,0 (référence) |
| Fructose | 1,3 |
| Glucose | 0,7 |
| Galactose | 0,6 |
| Maltose | 0,5 |
| Lactose | 0,3 |
Le pouvoir sucrant varie en fonction de nombreux paramètres :
- la concentration (lorsque la concentration en glucide augmente l’écart relatif entre leur pouvoir sucrant diminue),
- la température (la sensation sucrée est accentuée à froid),
- la stéréochimie du lactose (pouvoir sucrant du lactose b est supérieur à celui du lactose a).
- les associations à d’autres substances (sels, acides, autres glucides, etc.),
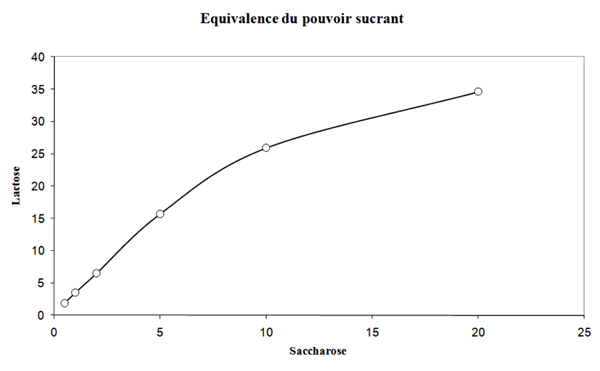
Représentation de l’équivalence de pouvoir sucrant entre le saccharose et le lactose
2. 3 Pouvoir réducteur
La fonction réductrice du lactose est portée par son carbone anomèrique. Lorsque la molécule de lactose est en configuration ouverte, le carbone anomérique expose une fonction aldéhydique réactive, en particulier pour les réactions de brunissement non enzymatique qui résultent de l’attaque nucléophile des groupements amines sur le carbone réducteur.
Après réarrangement d’Amadori, la lactosylamine se décompose en une diversité de molécules acides (acide formique, acétique, etc.), aromatiques et sapides (aldéhydes, hétérocycles, etc.), etc. qui ensuite au cours de l’avancement de la réaction se polymérisent et engendrent des composés colorés (mélanoïdines).
Mécanisme général des réactions de brunissement non enzymatique
Vous devez mettre à jour votre lecteur Flash pour voir cette animation !
Si le problème persiste, vérifier que le JavaScript soit bien activé dans votre navigateur.
De nombreux paramètres physicochimiques influencent le brunissement non enzymatique. Il s’intensifie avec l’augmentation de la température, est maximum pour une aw voisine de 0,7 et pour des pH voisins de la neutralité. Le brunissement non enzymatique se traduit par des modifications organoleptiques (couleur, saveur), accompagnées d’une réduction de la valeur nutritionnelle (baisse de la quantité de lysine disponible) et parfois de la fonctionnalité (baisse de solubilité des protéines) des produits.