Wiki des méthodes de biologie moléculaire et cellulaire
Glossaire collaboratif des méthodes expérimentales de biologie moléculaire et cellulaire. Ce glossaire est réalisé par les étudiants du module "Méthodes expérimentales de biologie moléculaire et cellulaire" sous la supervision de l'équipe de Génétique Animale.
Spécial | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | Tout
N |
|---|
| VN | Northern and Southern blots | ||
|---|---|---|---|
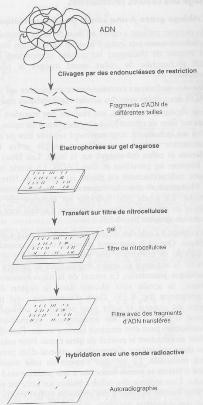
1. ObjectifsLe Southern Blot (appelé aussi "transfert de type Southern") est une technique proposée par Edward M. Southern en 1975. C'est un outil très efficace pour l'analyse de la structure d'un gène. (Watson, 1992, pp. 127 - 130) Son but est de rechercher des fragments d'ADN sur une électrophorèse en les hybridant avec une sonde complémentaire. (Faculté de Médecine Pierre et Marie Curie) On peut par exemple employer cette méthode pour comparer l'ADN avec d'autres échantillons d'ADN et ainsi retrouver des délétions ou des remaniements dans lesquels un gène serait impliqué. (Watson, 1992). On peut aussi s'en servir pour comparer différents gènes intra-espèces ou inter-espèces. On peut comparer des collections d'ADN issues de différents organismes pour étudier la conservation d'un tel ou tel gène. (Watson, 1992) La même technique mais appliquée au ARN est appelée transfert de type Nothern. (Maftah, 1996) Elle est à la base de la plupart des informations sur l'expression des gènes, sur les fonctions d'ARN aujourd'hui connues. Cette technique est particulièrement intéressante pour évaluer un clonage d'ADNc. Elle permet de comparer la taille de l'ARNm avec celle de l'ARNc et ainsi savoir si l'ADNc est bien complet. (Watson, 1992, p. 130) Elle permet aussi de savoir dans quelles cellules un gène ou ses facteurs d'expression s'expriment. En plus, on peut analyser l'activité des cellules par extraction et quantification de l'ARN de ces cellules à des instants différents. 2. PrincipeLes deux techniques consistent à faire hybrider une sonde marquée sur des séquences d'ADN (Southern blot) ou sur de l'ARN (Northern blot) afin de mieux connaitre les séquences d'un échantillon. 3. Mode opératoire
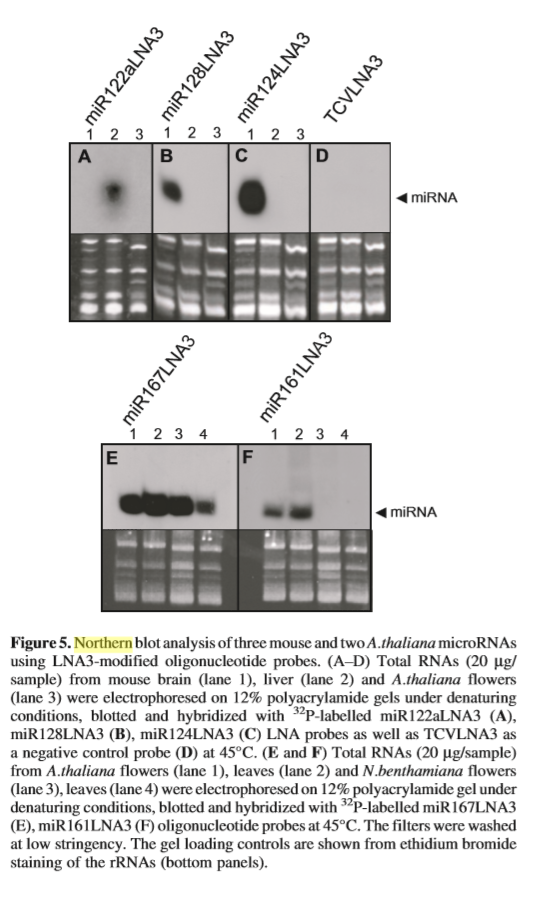
Tout d'abord, pour réaliser un Southern blot, il faut avoir coupé préalablement les fragments d'ADN avec des enzymes de restriction et fait migrer l'ADN dans du gel d'agarose par la technique d'Electrophorèse. Par la suite on applique sur le gel un filtre de nitrocellulose ou une membrane de nylon et on fait circuler un tampon du gel vers la membrane. Ainsi les fragments d'ADN sont transférés et fixés par UV ou chauffage sur la membrane et on obtient une "réplique" du gel sur le filtre de nitrocellulose ou la membrane en nylon. La prochaine étape consiste à mettre en contact la réplique avec une sonde d'ADN simple brin ou d'ARN connus, marqués radioactivement, un ADNc cloné ou une courte oligonucléotide connue. Cette sonde simple brin connue va s'hybrider sur les molécules correspondantes à la séquence complémentaire présentes sur le filtre. Les fragments de la sonde non hybridée sont éliminés par la suite par un lavage avec des solutions salines de différentes forces ioniques. Une autoradiographie de la membrane va révéler des bandes d'ADN hybridés avec la sonde. On peut y voir le nombre et la taille des fragments d'ADN qui possèdent une séquence complémentaire à celle de la sonde. (Watson, 1992) Cette autoradiographie est aussi appelée "carte de restriction" d'un ADN car on peut ainsi déterminer la position des sites de restriction au sein de cet ADN. (Maftah, 1996) La technique du Northern blot suit le même mode opératoire mais vue que les séquences d'ARN sont petites, la digestion préalable n'est pas nécessaire. On obtient aussi une autoradiographie. 4. Intérêts/LimitesL'avantage principal d'un Southern et Northern blot est son application relativement facile. Néanmoins le manipulateur doit prendre des précautions pour protéger son échantillon des ARNases, et soi-même de produits chimiques et UV. Un autre avantage est qu'on peut mettre le choix des enzymes de restriction qu'on possède actuellement au profit d'un Southern blot plus précis que dans le passé. Les deux techniques permettent aussi de détecter la taille d'ADN ou d'ARN. Des techniques d'hybridation alternatives sont le FISH, le PCR – in situ, l'ASO (dot blot et reverse dot blot) etc. Parmi les inconvénients d'un Southern ou Northern blot on peut citer la quantité minimale nécessaire pour mettre en place la méthode qui est de 1µg d'ADN, soit 150 000 cellules. A titre indicatif, pour un PCR il peut en théorie suffire une seule cellule. Aussi, cette technique fournit une analyse moins fine que la méthode FISH, PCR – in situ ou la méthode du branched DNA, elles concentrées sur des séquences d'intérêt plutôt que sur des fragments de restriction. (Serre, 2002, pp. 46 - 49) Enfin, elle est relativement longue car pour réaliser l'autoradiographie, il faut que le filtre soit en contact avec le film photographique pendant plusieurs jours. (Demay) L'étape critique d'un Southern ou Northern blot est le lavage de la membrane des hybridations ou adsorptions non spécifiques possibles avec la sonde. Il est réalisé après l'hybridation entre la sonde et l'ADN ou ARN étudié et avant la réalisation de l'autoradiographie. Elle influe sur la qualité, la sensibilité et la fiabilité des résultats. On définit par "stringence" la puissance avec laquelle a été effectué le lavage. Plus la température est élevée (effet sur les liaisons H), plus la force ionique est faible et plus la concentration en détergent est élevée, plus la stringence sera forte et donc la sonde va se décrocher. (Serre, 2002, p. 49) 5. Expression de résultatsOn obtient par l'intermédiaire de la méthode du Southern blot une "carte de restriction" qu'on peut comparer avec les cartes de restriction des autres échantillons d'ADN connus ou justement méconnus. (Maftah, 1996) En voici un exemple : Figure 2 Illustration des fragments après migration, Les outils de génétique moléculaire, Fanny Demay Ici, dans le puit 1 un échantillon d'ADN avait été digéré par l'enzyme Eco RI. Dans le puit 2 se trouve l'ADN digéré par Hind III alors que dans le puit 3, l'ADN avait été digéré par les deux enzymes à la foi. On voit donc qu'en fonction des enzymes de restriction qui ont digéré l'ADN, on aura une carte de restriction différente. En ce qui concerne le Northern blot, l'autoradiographie n'est plus appelée une carte de restriction car il n'est pas nécessaire de séquencer l'ARN. En voici un exemple : Figure 3 Northern Blot analysis, Sensitive and specific detection of microRNAs by Northern blot analysis using LNA-modified oligonucleotide probes (Vàloczi, 2004) 6. Interprétation de résultatsLes résultats sur une carte de restriction peuvent être lus comme les morceaux d'un puzzle et comparés entre différents échantillons d'ADN, qu'ils soient humains (tests de paternité, identification d'une maladie génétique) ou appartenant à des différentes espèces (le Zoo 7. BibliographieDemay, F. (s.d.). Récupéré sur Cours B.T.S. BioAnalyses et Contrôles: Faculté de Médecine Pierre et Marie Curie. (s.d.). Préparation des acides nucléiques. Caractérisation des acides nucléiques, (p. 9.9 Southern blot). Paris 06. Maftah, J. (1996). Biologie moléculaire. Masson. Serre, J.-L. (2002). Les Diagnostics Génétiques. Paris: Dunod. Vàloczi, A. (2004). Nucleic Acids Research, Vol 32 No 22, Sensitive ans specific detection of microRNAs by Northern blot analysis using LNA-modified oligonucleotide probes. Vedbaek: Oxford University Press 2004. Watson, G. W. (1992). ADN Recombinant. De Boeck Université. | |||