Wiki des méthodes de biologie moléculaire et cellulaire
Glossaire collaboratif des méthodes expérimentales de biologie moléculaire et cellulaire. Ce glossaire est réalisé par les étudiants du module "Méthodes expérimentales de biologie moléculaire et cellulaire" sous la supervision de l'équipe de Génétique Animale.
Spécial | A | B | C | D | E | F | G | H | I | J | K | L | M | N | O | P | Q | R | S | T | U | V | W | X | Y | Z | Tout
B |
|---|
| CM | BICINCHONIQUE ACID ASSAY (BCA) | |
|---|---|---|
bicinchonique Acid Assay (BCA)
I - Objectifs La quantification protéique par l’acide bicinchonique (ou BC Assay) est une méthode qui permet de déterminer la concentration en protéines d’un échantillon par colorimétrie. L’équation de la droite donnant l’absorbance en fonction de la concentration pour chaque standard permet de calculer la concentration d’un échantillon à partir de son absorbance. Cette technique est notamment utilisée avant la réalisation d’un western blot : les échantillons sont chargés de sorte qu’ils aient la même concentration. Une BC Assay est donc réalisée afin de diluer convenablement la solution protéique à l’aide des concentrations calculées à partir des données d’absorbance.
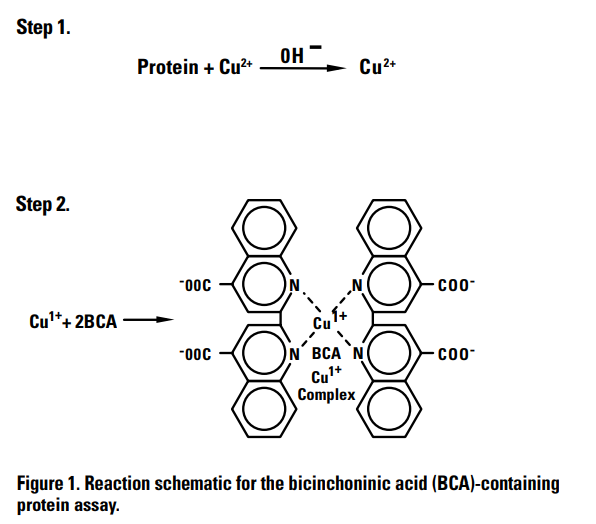
II - Principe La méthode repose sur le fait que l’absorbance est directement proportionnelle à la concentration en protéines d’un échantillon. Or, en milieu alcalin, les ions Cu2+ sont réduits en Cu+ par les protéines de l’échantillon. Puis, l’ajout de l’acide bicinchonique permet la formation d’un complexe spécifique [Acide Bicinchonique/Cu+] qui prend une teinte violette dont le maximum d’absorption se trouve à 562 nm (Walker, 1994). Figure 1 : Réactions chimique réalisée au cours du dosage colorimétrique entre protéines, ions cuivriques et BCA (Thermo Scientific, 2009) III - Mode opératoire Tout d’abord, une gamme de dilution d’Albumine de Sérum bovin (ABS) (initialement concentré à 0.5 mg/ml dans de l’eau) est réalisée. Les standards sont les suivants :
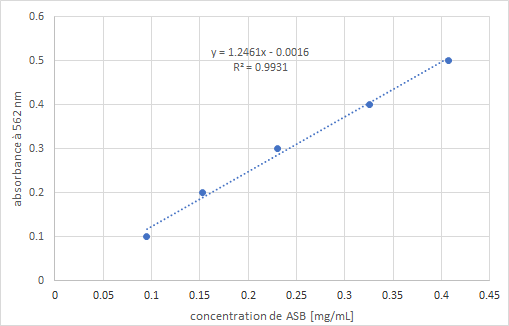
Les différents échantillons sont déposés dans chaque puits en prenant soin de retirer les cônes entre chaque dépôt. Le facteur de dilution a été déterminé par une BCA dans laquelle il y aurait une gamme de dilution pour l’ABS et une autre pour l’échantillon en question : le facteur à prendre sera alors celui dont la couleur se situe dans la gamme de couleurs de l’ABS dans l’eau. Chaque échantillon est placé en duplicata dans les puits en prenant soin de les vortexer au préalable et de changer de cône. Une fois tous les échantillons chargés, la solution BCA est préparée en combinant la solution claire (BCA Reagent A à 4.9 ml) et la bleue (BCA reagent B à 100 μl). 200 μl de cette solution colorée sont déposés dans chacun des puits. La plaque est incubée à 37°C pendant 30 minutes, puis passée au spectrophotomètre. L’absorbance de chaque valeur permettra de déterminer la concentration de chaque échantillon à partir de l’équation de la droite d’étalonnage réalisée grâce aux standards. IV - Présentation des résultats Le lecteur de plaque (ou spectrophotomètre) donne des valeurs d’absorbance pour chaque puits. La valeur d’absorbance du standard 6 est soustraite (information background) à toutes les autres, puis la moyenne de chaque dépôt déposé en double est calculée. Ensuite, une droite est tracée en prenant en paramètre l’absorbance de chaque standard en ordonnée et leur concentration en abscisse. Puis, via l’équation de la droite, la concentration de chaque échantillon est obtenue ; une moyenne sera faite entre les duplicatas. Il ne faut évidemment pas oublier de prendre en compte la dilution effectuée au cours de l’expérience dans ses calculs.
Figure 2 : Présentation d’un résultat de BCA avec l’exemple de l’albumine de bovins (Andrew, 2018, résultats non publiés)
NB : Les résultats ne seront valables que dans la mesure où :
V - Intérêts et limites Les avantages sont la rapidité et la simplicité, puisqu’elle peut être faite en une étape (30 minutes pour déposer les échantillons et 30 minutes d’incubation à 37°C), contrairement à la méthode de Lowry (autre méthode de quantification colorimétrique), qui elle en nécessite deux (Lowry et al., 1951 et Smith et al., 1985). Cependant, des interférences peuvent venir perturber les données d’absorbance de la solution : des substances réduisant le cuivre, des acides aminés et des réactifs chélatant le cuivre (production d’un couleur, donc manque de précision de la protéine utilisée). Néanmoins, la BC Assay serait plus tolérante face à la présence de composés qui seraient susceptibles de brouiller les résultats, contrairement à la méthode Lowry (Thermo Scientific, 2009). En revanche, la fiabilité de cette méthode dépend fortement de la précision de l’utilisateur lorsqu’il réalise les dépôts et peut par conséquent manquer de précision selon la qualité des dépôts. Étant donné les réactifs utilisés, elle reste aussi coûteuse.
VI - Références bibliographiques Lowry OH, Rosebrough NJ, Farr AL, and Randall RJ. (1951). Protein measurement with the Folin phenol reagent. J Biol Chem. 193(1):265-75. Smith PK, Krohn RI, Hermanson GT, Mallia AK, Gartner FH, Provenzano MD, Fujimoto EK, Goeke NM, Olson BJ, and Klenk DC (1985). Measurement of protein using bicinchoninic acid, Anal.Biochem. 150 (1), 76-85 Thermo Scientific Pierce Protein Assay Technical Handbook, (2010), p.15-20 Walker J, (1994) The Bicinchoninic Acid (BCA) Assay for Protein Quantitation. Methods Mol Biol. 32,5-8. | ||
| JB | BIOLISTIQUE | |
|---|---|---|
La biolistique I. Objectifs La biolistique, également appelée gene gun, est une méthode de transfert de gènes direct, notamment utilisée sur les cellules végétales (Tagu et al., 2018). Des micro-projectiles propulsés à haute vitesse introduisent des gènes d’intérêts dans les cellules cibles. Cette méthode est à la fois utilisée en recherche pour étudier l’expression génétique de certains gènes (Hamad et al., 2020) par exemple, mais également pour la production de nouvelles variétés, en agriculture (Sobańska et al., 2019).
II. Principe La biolistique consiste à projeter sur des tissus des micro-projectiles enrobés d'ADN à l'aide d'un canon à particules. Certains micro-projectiles pénètrent les membranes et arrivent dans le noyau. L’ADN transporté est libéré et peut être exprimé par la cellule (Tagu et al., 2018).
III. Mode opératoire Dans un premier temps, les micro-projectiles en tungstène ou en or de 1 à 3 µm de diamètre sont enrobés avec l’ADN d’intérêt par précipitation en présence de chlorure de calcium et de spermidine, qui favorisent son adhésion à la surface des billes. Ces micro-projectiles servent ainsi de vecteur pour faire entrer le gène d’intérêt dans les cellules cibles (Tagu et al., 2018). IV. Objectifs La biolistique, également appelée gene gun, est une méthode de transfert de gènes direct, notamment utilisée sur les cellules végétales (Tagu et al., 2018). Des micro-projectiles propulsés à haute vitesse introduisent des gènes d’intérêts dans les cellules cibles. Cette méthode est à la fois utilisée en recherche pour étudier l’expression génétique de certains gènes (Hamad et al., 2020) par exemple, mais également pour la production de nouvelles variétés, en agriculture (Sobańska et al., 2019).
V. Principe La biolistique consiste à projeter sur des tissus des micro-projectiles enrobés d'ADN à l'aide d'un canon à particules. Certains micro-projectiles pénètrent les membranes et arrivent dans le noyau. L’ADN transporté est libéré et peut être exprimé par la cellule (Tagu et al., 2018).
VI. Mode opératoire Dans un premier temps, les micro-projectiles en tungstène ou en or de 1 à 3 µm de diamètre sont enrobés avec l’ADN d’intérêt par précipitation en présence de chlorure de calcium et de spermidine, qui favorisent son adhésion à la surface des billes. Ces micro-projectiles servent ainsi de vecteur pour faire entrer le gène d’intérêt dans les cellules cibles (Tagu et al., 2018). Ensuite, les micro-projectiles sont propulsés, soit suite à une explosion de la poudre contenu dans le pistolet à gènes (figure 1), soit suite à la détente d’un gaz sous pression, souvent l’hélium. Certains micro-projectiles entrent en contact avec la paroi cellulaire et ralentissent lors de leur passage à travers les différentes membranes végétales (Wellmann et al., 1999).
Figure 1 : Pistolet biolistiqueSource : https://www.shutterstock.com/fr/ Ils peuvent atteindre aussi bien le cytoplasme que le noyau. Les micro-particules arrivant dans le noyau peuvent alors libérer l’ADN transporté, permettant ainsi l’expression du gène. Notons que la durée d’expression du gène inséré est variable (Tagu et al., 2018).
VII. Présentation des résultats La biolistique est une méthode d’insertion d’un gène, mais elle ne permet pas d’évaluer immédiatement si elle a été efficace à court terme. Tout d’abord, l’utilisation de PCR ou d’un gène rapporteur permet de vérifier l’arrivée du gène dans la cellule cible (Wellmann et al., 1999). Ensuite, réaliser un Southern Blot confirme l’intégration stable du gène dans le génome hôte. Et enfin, un Western Blot ou une RTqPCR atteste l’expression du gène dans le tissu cible (Sobańska et al., 2019).
VIII. Interprétation des résultats Une des principales méthodes pour visualiser l’insertion du gène d’intérêt est l'utilisation d’un gène rapporteur.
Figure 2 : Gènes rapporteurs EGFP (A et D) et lac Z (B et C) Wellmann H et al., 1999
Wellmann et al.(1999) utilisent deux gènes rapporteurs : GFP (figure 2.A et 2.D) et la lac Z (figure 2.B et 2.C). Le gène de la Green Fluorescent Protein est ajouté avec le gène d’intérêt et code une protéine fluorescente : GFP. Sous un microscope à fluorescence, le gène de la GFP permet de s’assurer de l’insertion du gène d’intérêt. Ils utilisent également un autre gène rapporteur : lac Z. Le gène lac Z est inséré avec le gène d’intérêt et code l’enzyme β-galactosidase. En présence du substrat X-gal (5-bromo-4-chloro-3-indolyl-beta-D-galactopyranoside), la β-galactosidase le dégrade et libère un composé qui précipite en bleu. Ainsi, dans les deux cas, l’insertion et la détection du gène rapporteur permet de s’assurer de la bonne insertion du gène d’intérêt. L'utilisation d’un gène rapporteur n’est pas l’unique solution pour s’assurer de l’efficacité de l’insertion du gène d’intérêt. Pour plus d'informations sur les autres méthodes, vous pouvez vous référer aux autres méthodes du wiki.
IX. Intérêts et limites La biolistique est simple, rapide et efficace, surtout chez les végétaux. Cette méthode peut également être appliquée à tout organisme possédant un génome. Cependant, elle est souvent moins performante que d’autres méthodes comme la transformation bactérienne dans le cas des cellules animales[JF1] (Sanford, 1988). De plus, elle repose essentiellement sur le hasard. En effet, il est nécessaire que les micro-projectiles atterrissent dans le noyau pour que cela fonctionne. Rappelons que le noyau de la cellule végétale mesure en moyenne 5 à 7 µm et que les micro-projectiles mesurent entre 1 et 3 µm. Les chances qu’un micro-projectile y arrive sont minces. De plus, il faut que le micro-projectile possède encore de l’ADN non altéré lors de la projection. Et pour finir, cet ADN, s’il s’intègre dans le génome, peut s’insérer n’importe où, y compris au milieu de séquences codantes qui seront alors endommagées, ou dans des zones inactives. Sachant que de trop nombreuses copies peuvent aussi être intégrées au génome de la cellule (Gallais, 2013).
X. Références bibliographiques Gallais A (2013) De la domestication à la transgénèse-Évolution des outils pour l’amélioration des plantes, éditions Quae Hamad MIK, Daoud S, Petrova P, Rabaya O, Jbara A, Melliti N, Stichmann S, Reiss G, Herz J, Förster E (2020) Biolistic transfection and expression analysis of acute cortical slices. Journal of Neuroscience Methods 337: 108666 Sanford JC (1988) The biolistic process. Trends in Biotechnology 6: 299–302 Sobańska K, Cerazy-Waliszewska J, Kowalska M, Rakoczy M, Podkowiński J, Ślusarkiewicz-Jarzina A, Ponitka A, Jeżowski S, Pniewski T (2019) Optimised expression cassettes of hpt marker gene for biolistic transformation of Miscanthus sacchariflorus. Biomass and Bioenergy 127: 105255 Tagu D, Jaubert-Possamai S, Méreau A (2018) Principes des techniques de biologie moléculaire et génomique, éditions Quae Wellmann H, Kaltschmidt B, Kaltschmidt C (1999) Optimized protocol for biolistic transfection of brain slices and dissociated cultured neurons with a hand-held gene gun. Journal of Neuroscience Methods 92: 55–64 | ||